Specyfika badań klinicznych produktów leczniczych oraz wyrobów medycznych
Badania kliniczne produktów leczniczych prowadzone są nad każdym nowym lekiem, który ma zostać wprowadzony do obrotu. Organizowane są także w przypadku konieczności zbadania bezpieczeństwa leków już zarejestrowanych, czy sprawdzenia ich skuteczności, jeżeli stosowane są w nowych wskazaniach medycznych.
Natomiast badania kliniczne wyrobów medycznych, jako element oceny klinicznej danego wyrobu, mają na celu weryfikację czy właściwości i działanie wyrobu są zgodne z wymogami zasadniczymi według Rozporządzenia MDR tj. sprawdzenie, czy działanie danego wyrobu medycznego jest skuteczne i bezpieczne.
Badania kliniczne wyrobów medycznych, co do zasady podlegają tym samym standardom etycznym co badania kliniczne produktów leczniczych. Natomiast nie każdy wyrób medyczny musi zostać poddany weryfikacji klinicznej – jest to pochodna klasy wyrobu (patrz rysunek poniżej)
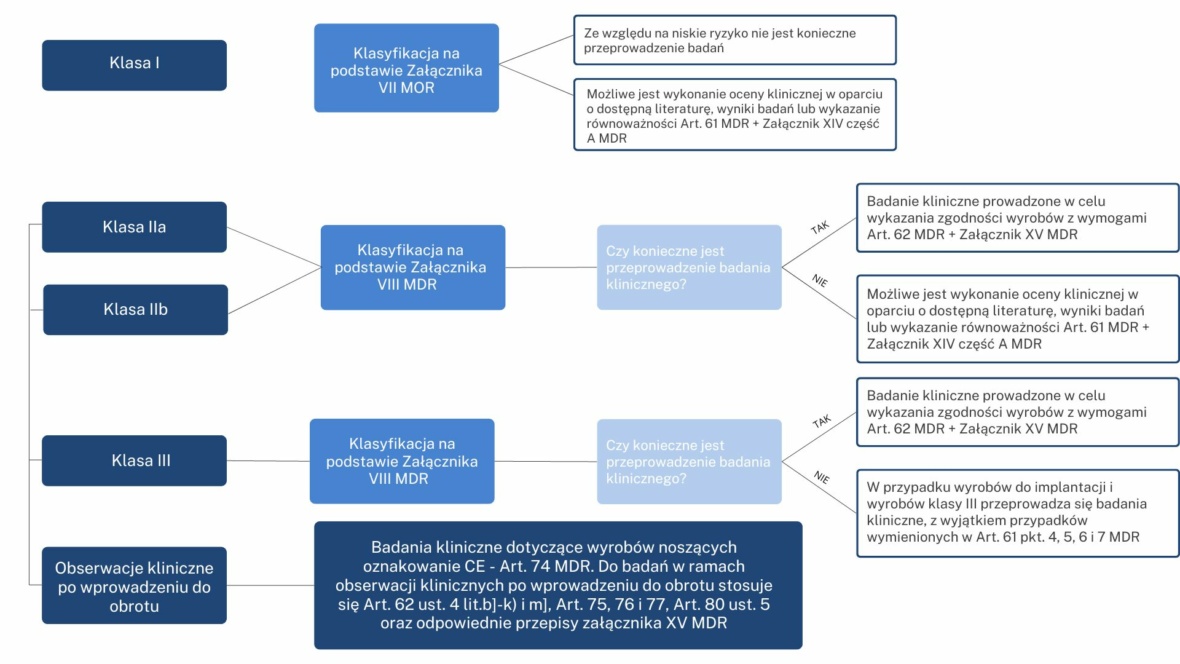
(autorzy schematu: dr hab. Marek Świerczyński, prof. UKSW, Karol Makowski Medigent LAB)
Ważną kategorią, wśród technologii medycznych są wyroby do diagnostyki IVD, które zgodnie z Rozporządzanie 2017/746 z dnia 5 kwietnia 2017 r. podlegają „ocenie działania”, w praktyce oznacza to badanie i analizę danych w celu ustalenia lub zweryfikowania znaczenia naukowego, skuteczności analitycznej – i w stosownych przypadkach- skuteczności klinicznej wyrobu.